
5月14-15日,由优尔医疗器械服务平台主办的“2025医疗器械监管科学与法规论坛”在京顺利召开。论坛汇聚医疗器械监管机构、学术权威代表及行业领军企业,围绕国际监管动态、技术创新与法规协同等议题展开深度研讨,旨在推动医疗器械行业高质量全球化发展。

睿展数据作为UDI实施专家受邀出席“医疗器械国际法规分论坛”。公司产品总监林磊以《FDA、MDR/IVDR法规与国内UDI规则实施差异》为题发表演讲,系统解析了欧美与中国UDI法规的差异化路径。

在全球医疗器械唯一标识体系加速落地的背景下,企业不仅需要深入理解国内UDI政策要求,更要同步关注国际法规动态。作为中国医疗器械出口的核心市场,美国FDA和欧盟MDR/IVDR框架下的UDI监管体系具有实施范围广、合规要求严、处罚力度大等特点,企业亟需建立兼具本土适配性和国际扩展性的UDI合规战略,以应对跨国监管挑战。
林老师从UDI执行时间表、法规框架、发码机构对比、UDI数据库注册流程、赋码规则等维度,对比分析欧美与国内UDI法规的核心差异,为企业出口合规提供关键决策依据。
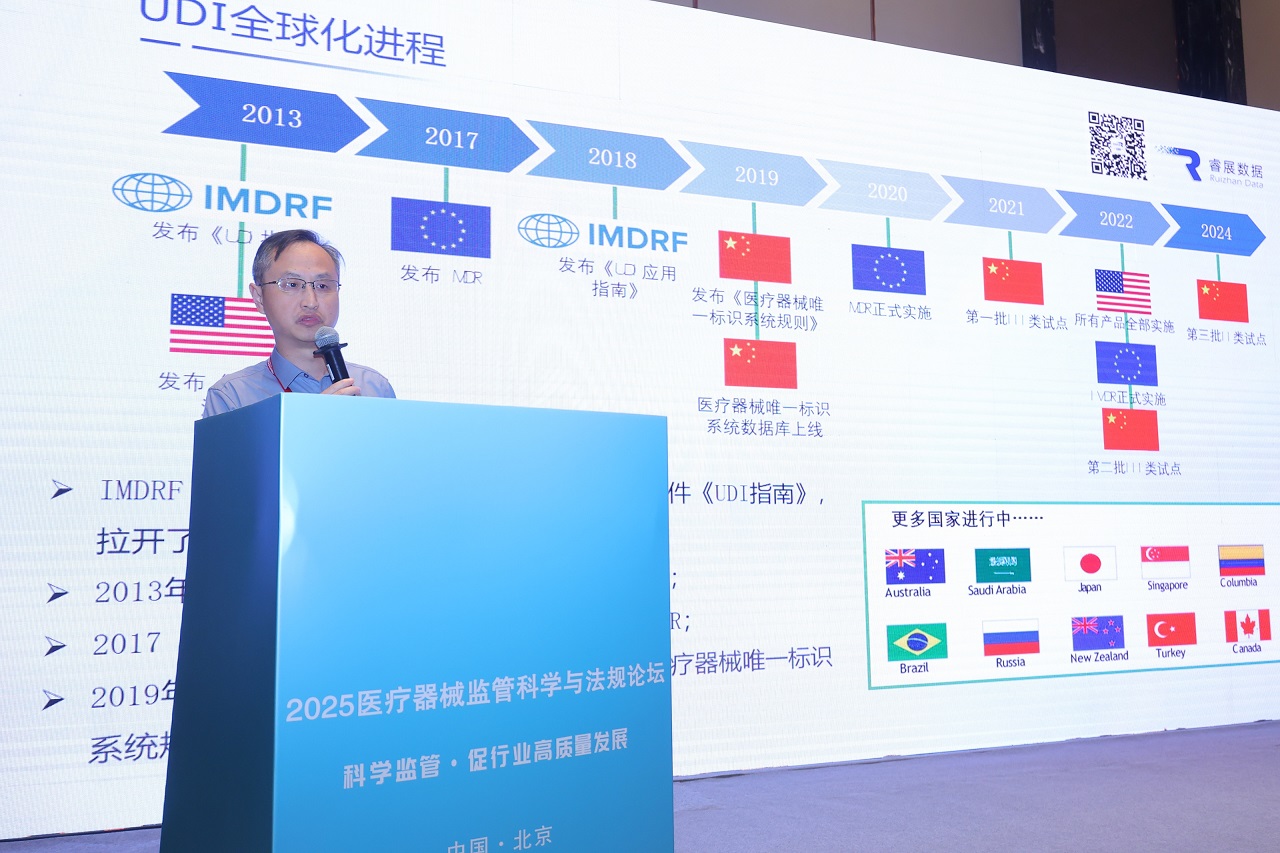
基于睿展数据千余例合规案例,林老师进一步分享了出口企业UDI落地的常见挑战及解决方案,涵盖编码规范、UDI载体选择、标签质量优化等实操环节。其演讲内容以方法论结合实践洞察,为与会企业构建了“合规-效率-成本”三位一体的实施框架,助力医疗器械产品高效出海。
作为UDI整体解决方案提供商,多年来,睿展数据深度参与国家UDI实施推进工作,产品、技术及服务持续走在行业前沿。论坛期间,公司自主研发的UDI全链路数字化解决方案精彩亮相,充分展示了睿展数据在医疗器械UDI合规领域的最新研究成果。
展台现场,睿展数据UDI专家小组与企业代表展开深入交流,针对UDI赋码合规、UDI数字化升级应用等场景提供定制化咨询,收获行业高度关注。


目前,睿展数据已服务众多企业成功实施UDI,覆盖IVD、医用耗材、医美器械、眼科器械、牙科器械、康复器械等多个细分领域,业务辐射中国、欧美、日韩等法规市场。未来,睿展数据将持续深化与医疗器械企业的合作,依托自主研发的UDI全链路数字化解决方案,通过技术创新与服务升级双轮驱动,助力更多企业实现从基础合规到数据价值升级转化的跨越式发展,共同推动UDI在医疗器械全生命周期管理中的创新应用。






